 拡大図(52KB) |
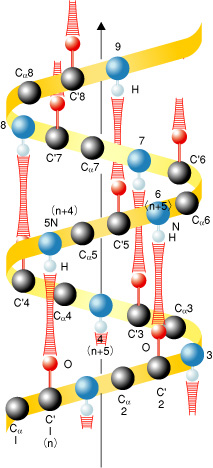
図4-13 ポーリングによって提案されたαヘリックスの基本構造 |
 |
||
|
 |
||
|
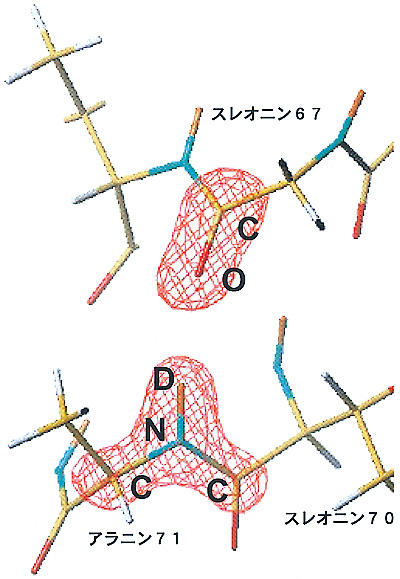
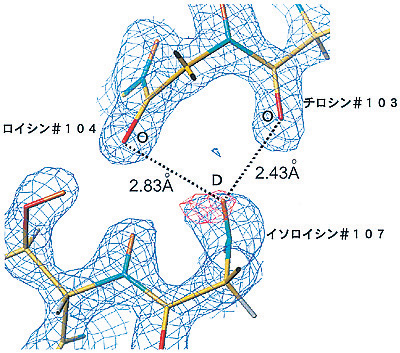
| タンパク質は三次元立体構造を形成する際、αヘリックスという基本構造をとることが、1951年ポーリングによって提案されました。その骨格構造はn番目のアミノ酸のC-Oとn+4番目のアミノ酸のN-Hが水素結合で結ばれ、らせん構造をとる構造モデルです(図4-13)。これはまずミオグロビンのX線結晶構造解析によってその存在と構造が確認されました。その後、多くのタンパク質のX線結晶構造解析が報告され、ポーリングの構造モデルを否定するものはなく、普遍的なものとみなされるようになりました。しかし、X線結晶構造解析ではすべての水素原子を正確に見ることはできないので、骨格構造のn番目のアミノ酸のC-Oとn+4番目のアミノ酸のN-Hが真に水素原子を介して結びつけられているかどうかまでは判定できませんでした。今回、私たちは中性子回折法でミオグロビンおよびリゾチームのαヘリックス中のすべての水素原子を決定したところ、骨格構造の水素結合の多くは確かにポーリングのモデルを指示する構造です(図4-14)が、いくつかのn+4番目のアミノ酸のN-Hはn番目のアミノ酸のC-Oとだけでなくn+1番目のアミノ酸のC-Oとも水素結合していることが見い出されました(図4-15)。つまり、αヘリックスはポーリングモデルで示される通常の水素結合と今回新たに確認された2分岐水素結合構造とで複雑なネットワークを形成していることが判明しました。αヘリックス2分岐水素結合構造は、今回、ミオグロビンとリゾチームという全く異なる2種類のタンパク質でそれぞれ見い出されたので、これ以外の他のタンパク質でも見い出されるごく一般的な構造と考えられます。 |
| ●参考文献
N. Niimura, Neutron Protein Crystallography in JAERI, J. Phys. Soc. Jpn., 70 (Suppl. 1), 396 (2001). |
| ご覧になりたいトピックは左側の目次よりお選びください。 |
|
たゆまざる探究の軌跡−研究活動と成果 2001 Copyright(c) 日本原子力研究所 |