 |
||
|
 |
||
|
| ルブレドキシン(Rd)は電子伝達蛋白質といわれていますが、機能の正体は正確にはわかっていません。また、高度好熱菌から採られた野生型Rdは摂氏92度のお湯に2日間つけておいても変成しない熱に非常に強い蛋白質として応用面でも大変興味をもたれていますがその理由もわかっていません。最近、お湯中で1時間以内に変成してしまう熱にそれほど強くないRd変異体を遺伝子組替技術で作り、両方の構造の違いをX線で詳細に調べた結果が報告されていますが、それでも構造上特別な差異は見い出されませんでした。これから推測されることは、熱安定性はX線では観測困難な水素あるいはタンパク質の周囲にある水分子のタンパク質への結合の違いに起因するのではないだろうかということです。私たちはこれを実証するため、まず熱安定な野生型Rdの中性子回折実験を行いました。
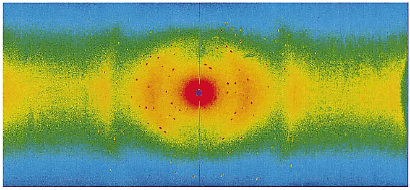
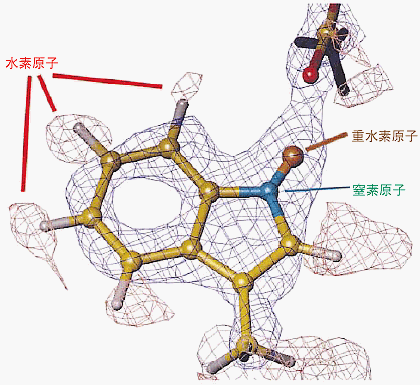
実験はJRR-3に新たに設置した中性子イメージングプレート付生体物質中性子回折計(BIX-3)を用いて行いました。生データを図1-13に示します。図にあるたくさんの赤い斑点はRd結晶からの中性子回折像で、結晶を回転させることで可能な限り多くの結晶からの回折像を収集し、これらを解析しRdの構造を決定しました。図1-14にこのようにして決められたRdの一部のトリプトファン残基の水素原子を含めた構造を示します。これは、現時点で世界最高分解能(1.5 Å)の結果であり、Rdの熱安定性の起源の解明に一歩近づいたものと言えます。今後は、BIX-3を駆使して、種々の基本的なタンパク質について、水素や水分子を含めた立体構造と機能発現機構の解明を行っていきます。 |
| 参考文献
K. Kurihara et al., Neutron Diffraction Study on the Structure of Rubredoxin from Pyrococcus Furiosus, J. Phys. Soc. Jpn., 70 (Suppl. A), 400 (2001). |
| ご覧になりたいトピックは左側の目次よりお選び下さい。 |
|
たゆまざる探究の軌跡−研究活動と成果2000 Copyright(c)日本原子力研究所 |