4-3 |
病態蛋白質の挙動を中性子で探る
|
 |
||
|
 |
||
|
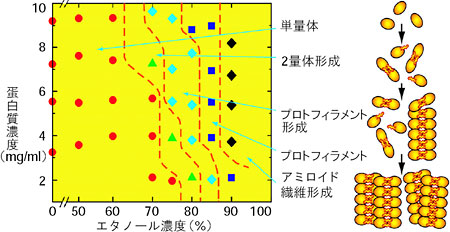
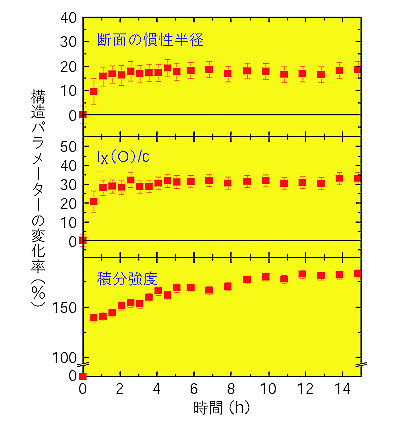
| アルツハイマー病を含む種々の神経疾患や牛海綿状脳症(BSE、いわゆる狂牛病)等のアミロイド疾患は、蛋白質がアミロイドと呼ばれる繊維状構造体を形成し、それが沈殿して組織に沈着するという特徴を持っています。近年、アミロイド疾患に関係した蛋白質だけでなく、広く種々の蛋白質がアミロイド繊維を形成することが知られてきました。アミロイド繊維形成機構の解明はアミロイド疾患の治療・予防という医学上のみならず、蛋白質化学上からも非常に重要な問題となっています。 私たちは、アミロイド繊維形成のモデル蛋白質としてニワトリ卵白リゾチーム(HEWL)を用い、そのエタノール溶液中でのアミロイド繊維形成過程をX 線小角散乱や中性子小角散乱を用いて調べています。小角散乱法は、溶液中での蛋白質の形態や会合状態を知ることができる重要な測定手段です。様々なHEWL 濃度、エタノール濃度中でのX 線及び中性子小角散乱実験の結果からアミロイド繊維形成の相図を作成し、HEWL のアミロイド繊維形成は、2量体の形成、プロトフィラメントの形成、そしてプロトフィラメントの会合によるアミロイド繊維の形成という経路で進むことを明らかにしました(図4-6)。さらにアミロイド繊維形成過程におけるHEWL の構造状態の時間変化を時分割中性子小角散乱法によって調べています。得られた構造パラメーターの時間変化の仕方から、プロトフィラメントの会合によるアミロイド繊維の形成に続き、アミロイド繊維同士の会合が起こることが明らかとなりました(図4-7)。 このように、中性子小角散乱法やX 線小角散乱法を用いてアミロイド繊維形成過程を明らかにすることが、アミロイド疾患の病態の解明、ひいては治療・予防への貢献へとつながることが期待されます。 |
| ●参考文献 Fujiwara et al., Effects of Salt Concentration on Association of the Amyloid Protofilaments of Hen Egg White Lysozyme Studied by Time-resolved Neutron Scattering, J. Mol. Biol., 331, 21 (2003). |
| ご覧になりたいトピックは左側の目次よりお選びください。 |  |
| たゆまざる探究の軌跡−研究活動と成果2003 Copyright(c) 日本原子力研究所 |