4-6 |
中性子散乱で筋収縮制御の分子機構に迫る
|
 |
||
|
 |
||
|
 |
||
|
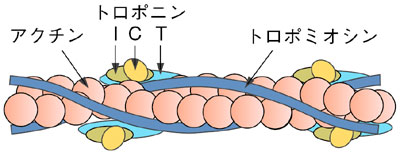
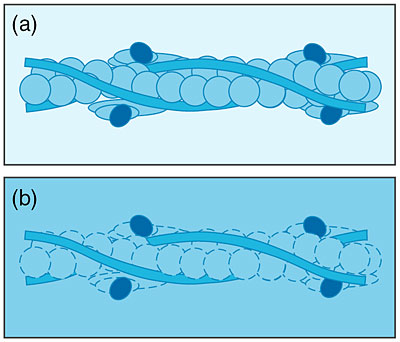
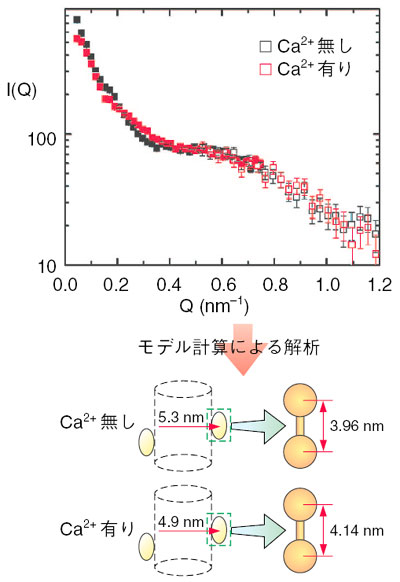
| 筋肉は、その主要成分である2種類の繊維状巨大蛋白質複合体「太いフィラメント」と「細いフィラメント」が互いに滑ることによって収縮します。筋収縮及びその制御の分子機構の解明は生物物理学上の重要な問題の一つです。筋肉は細胞中のCa2+濃度の上昇により収縮しますが、骨格筋や心筋では制御機構は細いフィラメントにあります。細いフィラメントではアクチン、トロポミオシン、トロポニンC、トロポニンI、トロポニンTという5種類の蛋白質が規則正しく配列しています(図4-16)。 細いフィラメントによる筋収縮制御機構の解明のためには、細いフィラメント中でのそれぞれの蛋白質の構造を知ることが非常に重要です。私たちは、その第一段階としてトロポニンCの構造を中性子小角散乱法を用いて調べました。トロポニンCを重水素化し、細いフィラメントに埋め込み、さらにトロポニンC以外の成分が「見えない」条件にして中性子小角散乱実験を行うことで、トロポニンCのみの構造情報を得ることができます(図4-17)。このような測定は中性子を用いることにより始めて可能となります。 中性子小角散乱実験の結果、細いフィラメント中のトロポニンCは、鉄アレイ様の形をしており、Ca2+の結合により約0.2 nm引き伸ばされると同時に軸方向に約0.4 nm近づくことが明らかとなりました(図4-18)。他の成分についても同様の測定を行い、得られた構造情報を組み合わせることで筋収縮制御に関与する蛋白質間相互作用の詳細が明らかになることが期待されます(本研究は科学技術振興調整費総合研究により補助を受けています)。 |
| ●参考文献 F. Matsumoto et al., Conformational Changes of Troponin C within the Thin Filaments Detected by Neutron Scattering, J. Mol. Biol., 342 (4), 1209 (2004). |
| ご覧になりたいトピックは左側の目次よりお選びください。 |  |
| たゆまざる探究の軌跡−研究活動と成果2004
Copyright(c) 日本原子力研究所 |