4-7 |
中性子回折で見るアミノ酸残基の水素化・脱水素化
|
 |
||
|
 |
||
|
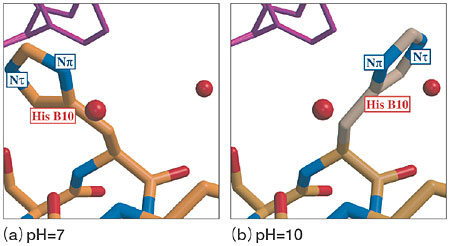
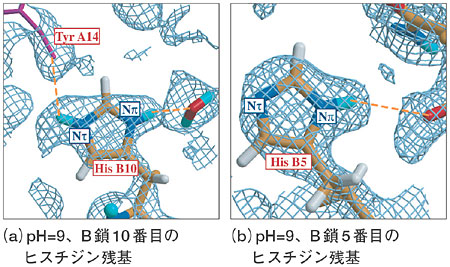
| 糖尿病の原因の一つにインスリン欠乏による糖代謝疾患があります。ブタ・インスリンは、ジスフィルド結合で結びついたA鎖(アミノ酸残基21個)とB鎖(アミノ酸残基30個)から成り、すい臓のB細胞が分泌するホルモンの一種で、血液中のグルコース濃度を制御する作用をしています。インスリンの薬剤効果解明の基礎的なデータを得るためには、水素・水和構造の決定が重要となります。X線結晶解析による研究では、pHを変化させると異なる配向をとるアミノ酸残基(例えばヒスチジン残基)(His B10:B鎖の10番目のヒスチジン)(図4-19(a)、(b))とそうでないもの(His B5:B鎖の5番目のヒスチジン)とがあることが知られていましたが、その原因は不明でした。 今回、JRR-3Mに設置されている構造生物用中性子回折装置BIX-3を用いてブタ・インスリンの中性子結晶構造解析を行った結果、ヒスチジン残基の水素化と脱水素化がその原因であることが判明しました。中性子の結果によれば、pH9ではHis B10のイミダゾール環のNπ位置の窒素とNτ位置の窒素の両方が水素化しています(図4-20(a))。ここで、Nτ位置の窒素の水素はA鎖のTyr14と水素結合を形成することで、 図4-19(a)の構造が安定化します。しかし、pHが高くなると、Nτ位置の窒素の水素は脱水素化してA鎖のTyr14との水素結合が壊れます。一方、Nπ位置の窒素の水素はそのまま残り、水分子と水素結合を形成し図4-19(b)が安定化します。一方、His B5のイミダゾール環の場合、すべてのpHで、Nπ位置の窒素は水素化していますが、Nτ位置の窒素は脱水素化しています(図4-20(b))。そのためpHが高くなってもヒスチジンの状態(水素化,脱水素化)に変化が起きないので、pH変化に対して、His B5は異なる配向をとらないと説明できます。つまり、イミダゾール環のNπ、Nτ位置の窒素の両方が水素化しているか否かが、pHの変化でヒスチジン残基の異なる配向をとるかどうかを決定付けていることが判明しました。 |
| ●参考文献 M. Maeda et al., Crystallization of a Large Single Crystal of Cubic Insulin for Neutron Protein Crystallography, J. Synchrotron Radiat., 11(1) , 41 (2004). |
| ご覧になりたいトピックは左側の目次よりお選びください。 |  |
| たゆまざる探究の軌跡−研究活動と成果2004
Copyright(c) 日本原子力研究所 |