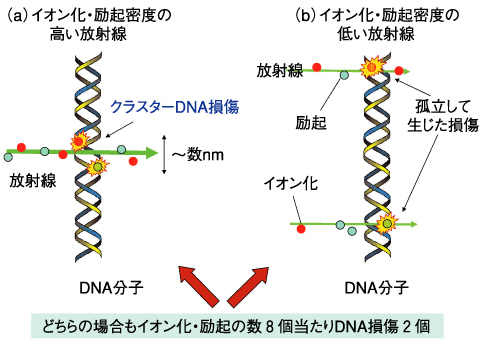
図6-11 放射線によるDNA損傷の生成
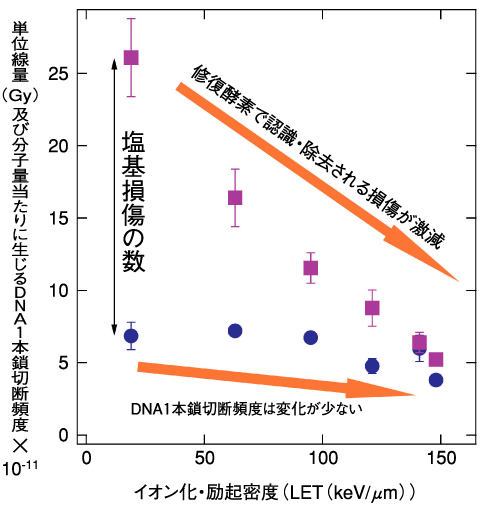
図6-12 DNA損傷頻度の放射線のイオン化・励起密度への依存性
生体は土壌や宇宙など環境からの放射線に絶えずさらされ、その結果ゲノム(DNA)に化学的な構造変化(損傷)が高い頻度で生じていることが知られています。生命は進化の過程で、これらのDNA損傷を効率良く除去し元に戻す仕組み(修復機構)を備えてきました。しかし、まれに修復がうまく働かない場合には、突然変異など重大な影響が現れます。私たちは、この原因となる難修復性のDNA損傷の実体解明を目指しています。
最近、nm程度の狭い領域に複数の損傷が同時に生じる、クラスターDNA損傷(図6-11(a))が提案されています。このような局所的に生じた複数の化学変化はDNAの立体構造を歪めてしまうため、修復酵素が損傷部位に結合できないと推測されます。しかし、これまでの分析化学的な方法で得られる損傷収率(線量当たりの損傷量)からは、実際に損傷がクラスター化しているかどうかについて知ることができません(図6-11)。
私たちはDNA損傷の「難修復特性」を明らかにするために、放射線照射したDNAに実際に修復酵素を作用させ、修復度合いを観測しました。損傷を局所的に高頻度で誘発するとされるHeイオンビームをDNAに照射し、グリコシラーゼと呼ばれる損傷塩基除去修復を行う酵素を加え37℃で30分間保持しました。この酵素は塩基損傷部位を認識するとこれをDNAから除去するため、結果としてDNAの片方の鎖の切断が生じます(1本鎖切断)。この性質を利用し、酵素反応により生じた1本鎖切断頻度をゲル電気泳動法で調べました。DNA損傷の密集状態は、Heイオンが試料中を進む軌跡上のイオン化や励起密度(線エネルギー付与,LET)に大きく依存します。そこでHeイオンビームのLETを系統的に変えた時に、酵素で除去されうる損傷の生成頻度がどのように変わるかを調べました。
図6-12は、放射線により直接生じたDNAの1本鎖切断頻度に加え、酵素反応により新たに生じた1本鎖切断の頻度を測定した結果を示しています。LETの増加とともに酵素の働きで生じる1本鎖切断頻度が、極端に減少していくことが明らかになりました。これは、LETが高くなるにつれて難修復性のDNA損傷が高頻度で誘発されるため、酵素の働きが阻害されていることを示唆しています。一方、従来DNA損傷の指標の一つとされてきた放射線で直接生じる1本鎖切断型損傷の頻度は、LETにそれほど大きく依存しません(図6-12)。更に、光子やイオンなど放射線の線質の違いにより難修復性のDNA損傷が誘発される頻度が大きく変わることが、修復酵素という生物学的な「目」を通して観察することで初めて明らかになりつつあります(Yokoya,A.,Invited Talk at the IXth International Workshop on Radiation Damage to DNA,2006)。これらの知見は、放射線リスク評価やがんの放射線治療など様々な放射線応用分野において、非常に重要な基礎データとなります。