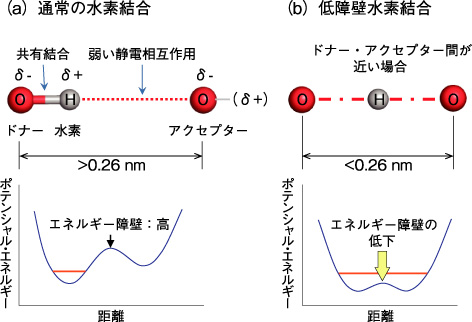
図4-21 水素結合と低障壁水素結合の概要
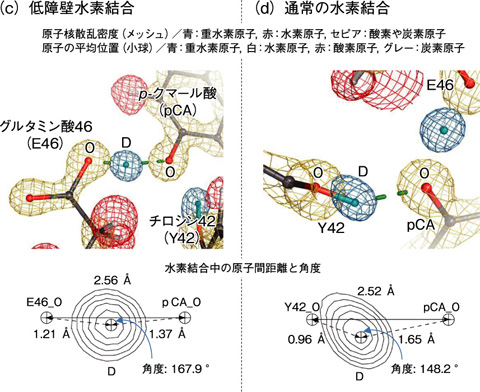
図4-22 イェロープロテイン中の低障壁水素結合と水素結合
水素結合(図4-21(a))はタンパク質の複雑な立体構造を保ち、酵素として触媒反応を行うために重要な役割を担っています。その水素結合の中でも「低障壁水素結合」(図4-21(b))という特殊な相互作用がタンパク質にも存在し、タンパク質の働きを支えていることを、私たちは世界で初めて証明しました。
「低障壁水素結合」は、高圧下や結晶の内部など特殊な条件下においた有機低分子で形成されることは知られていました。しかし、タンパク質では存在が予想されながら見つからないため、謎の水素結合として20年にわたる論争が続いていました。「低障壁水素結合」の証明には水素原子位置の同定が必要であり、私たちは、光受容タンパク質(イェロープロテイン)を材料に、高分解能中性子結晶構造解析という方法を用いて証明に成功しました。この方法により、イェロープロテインに含まれる819個の水素原子の位置が同定され、「低障壁水素結合」が安定に存在していることを突き止めました(図4-22)。重水を用いて結晶化するため、水素結合に関与する水素原子はすべて重水素に変換されています。図に示すように、光を吸収する発色団(p-クマール酸,pCA)のフェノール酸素とグルタミン酸46(E46)の酸素の中間に重水素原子が存在しています。この重水素原子はどちらの酸素とも共有結合していません。これが「低障壁水素結合」の直接的な証明です。pCAが光を吸収した状態では、二つの酸素間の距離が大きくなることが知られています。この状態では「低障壁水素結合」は形成できません。酸素間距離の拡大により、「低障壁水素結合」が通常の水素結合に変換しプロトン移動が起き、発色団に吸収された光エネルギーがタンパク質に伝わるという、これまで知られていなかった光情報伝達の新しいメカニズムを提唱することができました。また、今回の中性子結晶構造解析の結果、ドナー・アクセプター間の距離が近づくこと及び両者のpKa が一致することで「低障壁水素結合」が形成されることが示されました。
この研究成果は、タンパクの機能発現分子機構を理解するためには、水素の位置の同定ができる中性子構造解析が必須であることを示しています。また、「低障壁水素結合」と通常の水素結合の変換によりタンパク質の機能を調節する可能性が示されました。この水素結合の使い分けは、新しい創薬のデザイン原理を与えると期待されます。