図6-2 元素の周期表
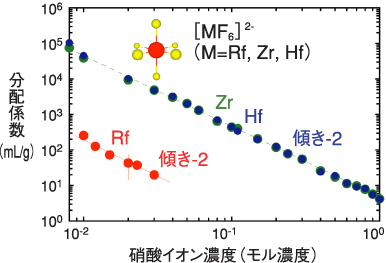
図6-3 硝酸イオン濃度に対するRf,Zr及びHfの分配係数の変化
原子番号が104を超える非常に重い元素を超重元素といい、図6-2に示すように周期表の最も下の位置に配置されています。一般に、周期表で縦方向に並ぶ同族の元素は類似した化学的性質を示しますが、実際には周期表を下がるにつれて少しずつ化学的性質は変化します。ところが、超重元素のように原子番号が極端に大きくなると電子軌道に相対論効果が強く働くため、電子軌道と密接に関係する化学的性質も影響を受けます。その結果、超重元素は同族元素の系統性から外れた性質を持つのではないかという興味深い予測がされています。
私たちは原子力機構のタンデム加速器施設を用いて104番元素ラザホージウム(Rf)を合成し、フッ化水素酸と硝酸の混合水溶液中における陰イオン交換挙動を詳しく調べました。そしてRfのフッ化物錯体の性質が周期表第4族の同族元素であるジルコニウム(Zr)やハフニウム(Hf)とは大きく異なることを初めて明らかにしました。
図6-3に、Rf,Zr及びHfの分配係数の変化を硝酸イオン濃度に対して示します。分配係数とは樹脂相と水溶液相に存在する元素の濃度比を表し、大きいほど樹脂相に多く存在することを意味します。図6-3から、硝酸イオン濃度が高くなるにつれて分配係数が減少していることが分かります。これは硝酸イオン濃度の増加とともに、このイオンがイオン交換樹脂の結合サイトに入り込み、Rf,Zr及びHfのフッ化物錯体を水溶液中に追い出すことを表しています。このデータが示す重要なポイントは、その減少の傾きがすべて−2であることです。この傾きはフッ化物錯体が−2の電荷を持つことを示し、RfがZrやHfと同じく六つのフッ化物イオンを配位したヘキサフルオロ錯体([RfF6]2−)を水溶液中で形成し、イオン交換樹脂に吸着していることが分かります。これは超重元素の化学種を初めて決定した重要な成果です。また、Rfの分配係数がZrやHfよりも約2桁も小さいことが分かります。私たちはこの違いの原因を探るため、更にフッ化物イオン濃度に対する分配係数の変化を調べました。その結果、同じヘキサフルオロ錯体を形成するためのフッ化物イオン濃度が、RfではZrやHfと比較して2桁高いことが分かりました。つまりRfヘキサフルオロ錯体は形成されにくく、Zr,Hfの錯体形成に比べてより多くのフッ化物イオンを必要とするわけです。図6-3におけるRfとZr並びにHfの分配係数の違いは、このフッ化物イオン濃度ではZrやHfがすべてヘキサフルオロ錯体として存在するのに対し、Rfの錯体形成が完全ではないということを示していることが分かりました。
フルオロ錯体の形成しやすさは、主にZr4+,Hf4+,Rf4+のイオン半径によって決まります。そのため、Rfがヘキサフルオロ錯体を形成しにくいことから、Rf4+のイオン半径がZr4+,Hf4+よりも大きいことが考えられます。また相対論効果は電子軌道に影響を及ぼし、イオン半径も変化すると考えられています。Rfのイオン半径にどのように相対論効果が影響しているのか、答えはまだ得られていませんが、今回の成果はその解明につながる重要な鍵となるでしょう。