図4-22 エラスターゼと阻害剤複合体の水素原子を含む全原子構造
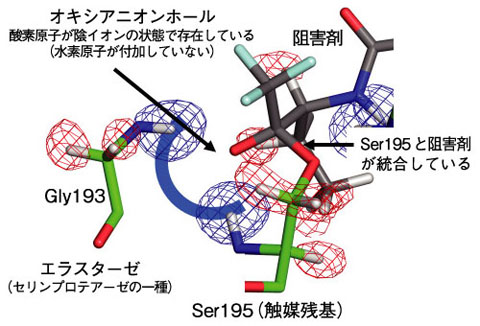
図4-23 中性子を用いて観測されたエラスターゼのオキシアニオンホールの立体構造
代表的なタンパク質分解酵素であるセリンプロテアーゼとその機能を抑制する化合物(阻害剤)の複合体結晶を作製し、研究用原子炉JRR-3に設置された生体高分子用中性子単結晶回折装置(BIX-3)を用いた中性子結晶構造解析によって、水素原子を含む全原子の構造解析に成功しました(図4-22)。
セリンプロテアーゼはセリンというアミノ酸をハサミとして使いペプチド結合を切断しますが、その切断反応過程においてオキシアニオン(酸素陰イオン)ホールと呼ばれる特徴的な構造が重要な役割を果たすと考えられています。オキシアニオンホールはセリンプロテアーゼが有する高い加水分解活性の発現に必要不可欠ですが、実際にどのように酸素原子を見分けているのかはこれまで明らかになっていませんでした。その解明には水素原子の情報を含む全原子構造情報を得る必要がありますが、タンパク質の主要構成元素の一つである水素原子の観測は大変難しいことが知られています。そこで私たちは、セリンプロテアーゼの一つであり、これまでに多くの構造学的知見が蓄積されているエラスターゼに着目し、阻害剤との複合体結晶を作製して、中性子ビームを用いた全原子構造解析を実施しました。
今回用いた阻害剤は、エラスターゼが本来その機能を果たす対象であるペプチドを模倣した立体構造を持つことでエラスターゼに結合し、更に触媒残基であるSer195と直接化学結合を形成することによって酵素反応の途中(反応中間体)で反応が停止し、エラスターゼの機能を止めるように設計されています。この複合体の立体構造解析の結果、図4-23に示すようにSer195と二つ隣のグリシン(Gly193)の主鎖のアミド基の水素原子の存在が中性子から明らかになり(青の編み目)、図中の半円(青)の場所にオキシアニオンホールが形成されていることが分かりました。さらに、オキシアニオンホールには阻害剤に由来する酸素原子が存在していますが、酸素原子に付加した水素原子は確認できず、酸素陰イオンの状態であることを世界で初めて確認することに成功しました。
今回得られた研究成果は、セリンプロテアーゼによる高度なタンパク質分解メカニズムの解明において重要な貢献をするものです。また、近年医薬品開発において一般的になりつつある立体構造情報を基盤とした創薬設計の手法の高度化に貢献することが期待されます。