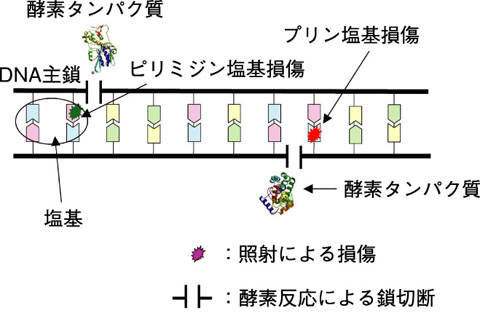
図7-10 酵素タンパク質を用いた塩基損傷の検出
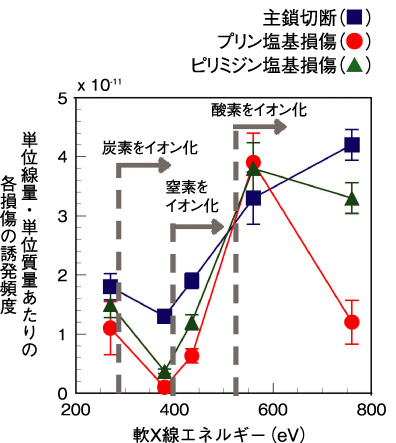
図7-11 各種DNA損傷の誘発頻度の軟X線エネルギー依存性
放射線によって生体に誘発される細胞致死や突然変異・発がんの主要な原因のひとつが DNA分子上に生じる化学変化(DNA損傷)であることが従来から指摘されています。そこで、もし放射線により特定の損傷を選択的に DNA分子中に誘発させることができれば、生体に対する放射線の影響を調べる分野の研究が大きく進展すると期待されています。 DNA分子は主鎖骨格部位(糖とリン酸基)と塩基部位から構成されます。 DNAの二重らせんの両鎖が切断されると、細胞致死が高い頻度で起こると言われています。一方、遺伝暗号を担う塩基にはプリン塩基とピリミジン塩基の二種類がありますが、その損傷は、突然変異の主要な原因とされています。そこで、 DNAを自在に切断する技術の開発を試みました。私たちは軟X線のエネルギーを選ぶことで DNA中の炭素,窒素及び酸素をそれぞれ選択的にイオン化し、この時に誘発される主鎖切断と塩基損傷のそれぞれの誘発頻度が変わるかどうかを探りました。実験には、塩基損傷を主鎖切断に変換することにより高感度で検出できるタンパク質を利用しました(図7-10)。その結果、照射した軟X線のエネルギーの違いにより、損傷の誘発頻度が大きく変化することが確認されました。
炭素のイオン化のみが起こる380eVの場合では、主として主鎖切断が生じます。一方、酸素をイオン化させた場合(560eV)、塩基損傷の誘発頻度が、窒素のイオン化(435eV)の場合に比べ約3倍にもなりました。更に酸素イオン化エネルギーを大きく超えた760eVの場合では、プリン塩基損傷が減少し、主鎖切断とピリミジン塩基損傷が主に誘発されます(図7-11)。
一般にプリン塩基は正孔を、ピリミジン塩基は電子を引き付けやすい性質を持ちます。それらの正孔や電子が塩基に損傷を引き起こす原因となることが知られています。また、主鎖切断は鎖中の糖部位の分解により誘発されます。軟X線の照射により生じた電子や正孔の挙動や、糖の分解のしやすさが、照射するエネルギーにより異なるため、軟X線のエネルギーに対する主鎖切断や塩基損傷の誘発頻度の違いが現れたと推測しています。このような性質を利用して、イオン化する元素を変えることで主要なDNA損傷の種類を選択することに成功しました。この技術は、今後生体への放射線影響を探るための強力なツールとして活用されると期待されます。