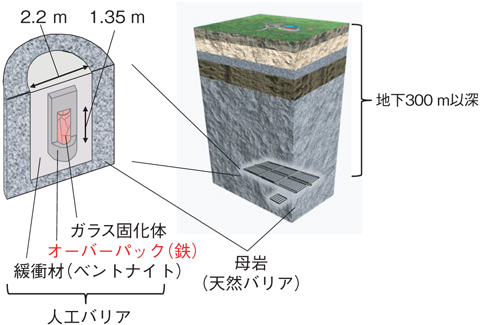
図6-9 地層処分場における高レベル放射性廃棄物の鉄製容器

図6-10 ガラスアンプルに封入した鉄試料及び腐食前後の試料表面
高レベル放射性廃棄物地層処分システムにおいて鉄製容器(図6-9)は、ガラス固化体が地下水と接触することを所期の期間は防ぎますが、その後も徐々に腐食し、緩衝材内の化学環境に影響を与えると考えられます。
深地下では酸素がほとんどなく、鉄は(1)や(2)に示す腐食反応を起こします。
Fe+2H2O→Fe(OH)2+2H++2e- (1)
3Fe+4H2O→Fe3O4+8H++8e- (2)
これらの反応は鉄が酸化される反応で、何らかの還元反応が同時に起こらなくてはなりません。この還元反応を起こしうる天然地下水の成分として、炭酸水素イオンや硫酸イオンがあります。炭酸水素イオンが還元されると、(3)に示すようにメタン(CH4)ができ、地下水は-350 mV(標準水素電極に対する酸化還元電位、以下同様)程度の還元的な条件になります。
HCO3-+9H++8e-→CH4+3H2O (3)
硫酸イオンが還元される場合には、類似の反応により地下水の酸化還元電位は-300 mV程度になります。
高レベル放射性廃棄物の中には、地下水中での動きやすさが酸化還元電位によって大きく変わるNpやSeのような元素があるため、鉄の腐食に伴って地下水がどのような酸化還元電位になるのかは重要です。またU,Np,Pu,Amのような元素は炭酸水素イオンが存在すると動きやすくなる性質がありますので、炭酸水素イオンが還元されてメタンに変化するかどうかも重要です。
私たちは酸素の侵入を防止できるガラスアンプルの中で、炭酸水素イオンと硫酸イオンを含む60 ℃の水によって鉄片を最長160日間腐食させ、どのような還元反応が起こるのかを調べました(図6- 10)。その結果、硫酸イオンと炭酸水素イオンが還元されないこと、代わりに水が還元される反応(4)が起こることが確認できました。
2H2O+2e-→H2+2OH- (4)
これは-500 mV程度の強い還元的な条件で起こる反応です。
本研究の結果は、容器としての寿命を超えた長期にわたり、鉄の腐食により人工バリア内は強い還元的な環境となるとともに、炭酸水素イオンが存在しうることを示しており、廃棄物処分の安全性を評価する上で重要なプロセスのひとつが明らかになりました。
本研究は、原子力規制委員会原子力規制庁(当時、経済産業省原子力安全・保安院)からの受託研究として実施しました。