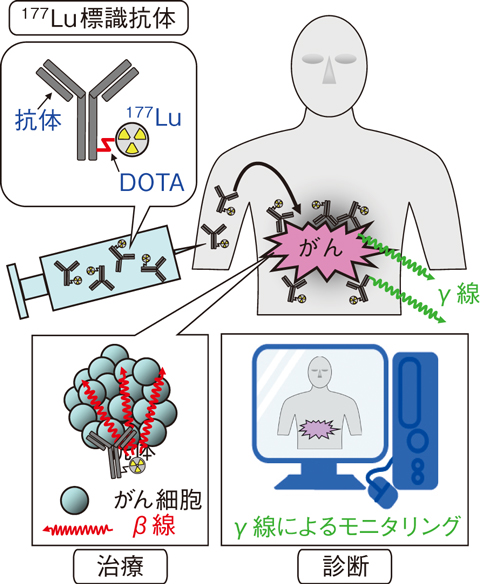
図5-29 177Lu標識抗体によるがんの治療及び診断
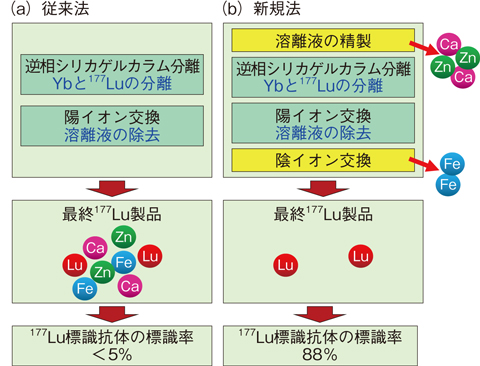
図5-30 中性子を照射したYbからの177Luの分離法
現在、β線を放出する核種が、がんの治療に用いられていますが、新たな治療用核種としてルテチウム177(177Lu)が有望視されています。これは、177Luがβ線だけでなく、体外から検出するのに適したγ線を放出する特徴を備えており、治療中の177Luの分布を調べて診断にも利用できると考えられるためです(図5-29)。
図5-29のようにがん細胞に特異的な抗体に、177Luを結合した177Lu標識抗体を用いて、177Luをがんまで届ける治療を放射免疫療法といいます。この治療法では、がん細胞に発現している抗原を頼りに抗体が177Luを運びます。このとき、ルテチウム同位体中の177Luの純度が低いと、がんに届く177Luが減ってしまい、治療効果が低下します。純度の高い177Luの生成には、中性子発生量の高い原子炉でルテチウムの安定同位体(176Lu)に中性子を照射し、176Lu(n, γ)177Lu反応で直接177Luを得る方法と、イッテルビウムの安定同位体(176Yb)に中性子を照射し、176Yb(n, γ)177Yb(半減期1.91時間)→ 177Lu反応で生成した177Luを分離して間接的に得る方法の二つがあります。176Luから177Luを生成させる直接法は、欧米のごく一部の地域にある中性子発生量の高い研究用原子炉でしか利用できませんが、間接法は、各国が保有する中性子発生量が低い原子炉でも利用可能です。そこで、間接法を利用してルテチウム同位体を含まない177Luをつくるため、Ybから177Luを化学的に分離する様々な方法が各国で検討されています。
これまでに私たちは、逆相シリカゲルカラムを用いてYbと177Luを完全に分離できる方法を開発しました(図5-30(a))。しかし、得られた177Luを用いて177Lu標識抗体を作製したところ、使用した177Luに対して177Lu標識抗体として得られたのは5%にも満たないものでした。その原因を探ったところ、使用した177Lu溶液の中に多量のカルシウム(Ca),鉄(Fe),亜鉛(Zn)が存在することが元素分析で確認され、これらが177Luと1,4,7,10-テトラアザシクロドデカン-1,4,7,10-テトラ酢酸(DOTA)との錯形成を競合的に阻害したため、177Luの標識率が低下したことを突き止めました。また、これらのCa,Fe,Znは、逆相シリカゲルカラム分離に用いる2-ヒドロキシイソ酪酸(2-HIBA)及び1-オクタンスルホン酸ナトリウム(1-OS)試薬の不純物として含まれていたことが分かりました。そこで、あらかじめ陽イオン交換カラム及びキレート交換カラムで精製するとともに、最終精製操作として陰イオン交換操作を追加しました(図5-30(b))。その結果、177Lu溶液中のCa,Fe,Znの濃度を87,340,77 ppbから13,18,9 ppbに低減し、177Lu標識抗体の標識率を88%に上昇したことで、ついに放射免疫療法に用いることができる高純度の177Luの製造に成功しました。
今回私たちが開発した製造法によって、世界各地で高純度177Lu製品の製造が可能となれば、今後177Luを用いた放射免疫療法が広く普及することが期待できます。