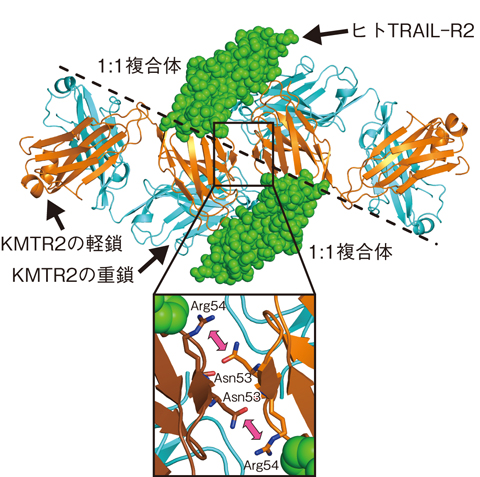
図5-31 結晶中に見いだしたメカニズムの基本単位
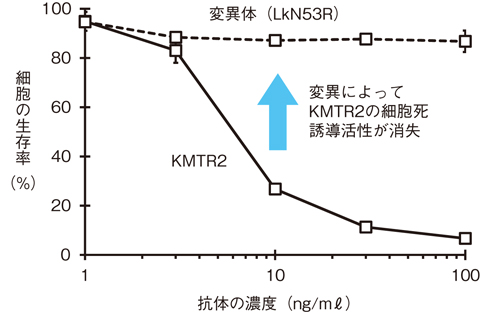
図5-32 がん細胞の細胞死誘導活性の比較
生体では、細胞の表面に様々なタンパク質が存在し、細胞の外側で特定の分子と作用することにより、生命現象にかかわる様々な信号を細胞の内側に伝えます。このように信号を「受け取る」役割を持つこれらのタンパク質のことを「受容体」と呼びます。がん(腫瘍)細胞の細胞死(アポトーシス)を引き起こす働きをする受容体の一つとして、「腫瘍壊死因子関連アポトーシス誘導リガンド受容体(TRAIL-R2)」が知られています。この信号はがん細胞においてのみ伝わることから、TRAIL-R2を標的とした抗がん剤の開発が盛んに行われています。そのうちの一つがKMTR2と呼ばれる抗体です。KMTR2がアポトーシスの信号をがん細胞に伝える際に、TRAIL-R2が数多く会合することが必須であることを、私たちは先行研究で明らかにしましたが、そのメカニズムについては分かりませんでした。
今回私たちは、KMTR2とヒトTRAIL-R2の反応にかかわる部分(KMTR2のFab領域とヒトTRAIL-R2の細胞外領域)を抜き出して、二つのタンパク質が1:1で結合する複合体(1:1複合体)の結晶を作製しました。この結晶に大型放射光施設SPring-8の強力なX線を照射し、2.1 Å という高い分解能でその三次元立体構造を決定しました。タンパク質は三次元的に規則正しく配列することにより結晶状態を形成しますが、結晶中の規則性に基づいた構造がタンパク質の機能に重要であることを、私たちはこれまでに別の研究において明らかにしています。本研究では結晶中の規則性に着目し、1:1複合体は隣の1:1複合体とKMTR2中の軽鎖間を認識し合うことにより2量体(2:2複合体)を形成(図5-31上)しており、この2:2複合体がヒトTRAIL-R2の会合構造の基本単位になっていると考え、その実証を試みました。2:2複合体は隣り合ったKMTR2軽鎖中のアスパラギン(Asn53)というアミノ酸とアルギニン(Arg54)というアミノ酸が認識しあうことで形成されていました(図5-31下)。このため、この認識を解消すれば2:2複合体の会合構造は形成されないと考え、Asn53をプラスの電荷を有し、かつ嵩高いアミノ酸であるアルギニン(Arg53)に置換した変異体(LkN53R)を作製しました。実際に、LkN53RではKMTR2で見られたようなヒトTRAIL-R2の数多い会合は観察されませんでした。さらに、がん細胞の生存率を比較した結果、LkN53Rでは濃度を高くしても生存率が下がらないことから、がん細胞の細胞死誘導活性が消失していることを実証しました(図5-32)。
今回の研究により、図5-31上で示した基本単位を『鍵』としてKMTR2ががん細胞を死に至らしめるメカニズムが原子レベルで明らかになりました。近年、抗体の特性を活かした分子標的治療が盛んに行われており、数多くの抗体分子が医薬品として臨床応用されています。本研究で得られた原子レベルでの知見は、より効果の高い抗がん剤の開発を推し進め、将来的に副作用が低減した抗がん剤の創製につながると期待されます。
本研究は、原子力機構と協和発酵キリン株式会社の2機関が共同で実施しました。