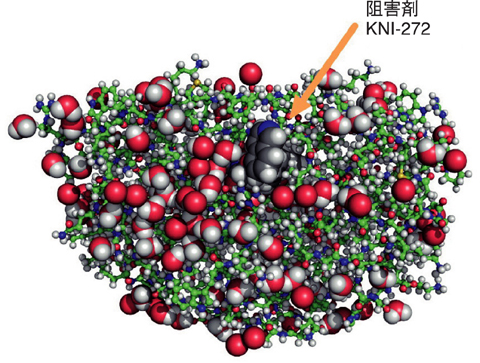
図4-18 HIV-1プロテアーゼと阻害剤KNI-272複合体の水素原子を含む全原子構造
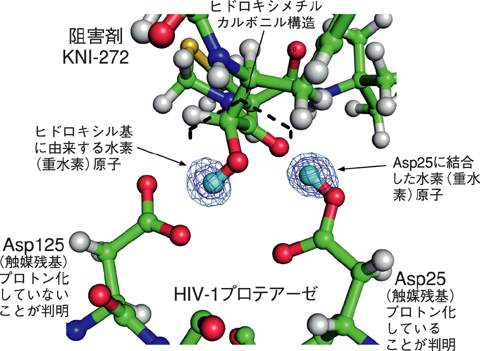
図4-19 HIV-1プロテアーゼの触媒中心の立体構造
エイズ治療薬の標的となるHIV-1プロテアーゼ(タンパク質)とその機能を阻害するKNI-272(化合物)の複合体結晶を作製し、中性子結晶構造解析によって水素原子を含む全原子の構造解析に成功しました。
HIV-1プロテアーゼは、二つのアスパラギン酸(Asp25とAsp125)を触媒残基とするタンパク質分解酵素であり、HIVの増殖に必須であることが知られています。したがって、HIV-1プロテアーゼの触媒機構及びその阻害剤との相互作用様式の解明が、抗エイズ薬(阻害剤)開発への重要な知見となります。HIV-1プロテアーゼの立体構造は、これまでにもX線結晶構造解析による解析例が多数報告されています。しかしX線は水素原子の検出に対して感度が低いため、機能発現に重要な水素原子は観察されていませんでした。そこで私たちは、水素(重水素)原子の検出に対して感度の高い中性子結晶構造解析を実施しました。
HIV-1プロテアーゼとその阻害剤KNI-272との複合体の中性子結晶構造解析には、原子力機構の研究用原子炉JRR-3に設置した生体高分子用中性子回折計装置BIX-4を用いました。得られたデータを解析することによってHIV-1プロテアーゼの全原子構造(図4-18)を決定することに成功しました。
今回用いた阻害剤KNI-272は、その中心にヒドロキシメチルカルボニルという特徴的な構造を持ち、HIV-1プロテアーゼの触媒残基と相互作用しています。触媒残基であるAsp25がプロトン化した状態で阻害剤KNI-272のカルボニル基と水素結合を形成し、阻害剤KNI-272のヒドロキシル基がプロトン化されていないAsp125と水素結合を形成することが明らかになりました(図4-19)。また、HIV-1プロテアーゼの触媒機構については、複数の説が提唱されていましたが、今回の結果からAsp25が基質となるペプチドにプロトンを供与すると同時にAsp125が加水分解に使われる水分子の活性化によって触媒反応が進行することが分かりました。
この成果は薬剤が直接作用するタンパク質の立体構造をより詳しくとらえたものであり、その構造的な特徴を利用して薬剤を設計することによって、更に効果的なエイズ治療薬の設計・開発段階で貢献できると考えています。
本研究は、原子力機構,京都薬科大学,大阪大学及び株式会社創晶の4機関が共同して実施したもので、原子力機構は主にHIV-1プロテアーゼの試料調製と中性子を用いた構造解析を行いました。