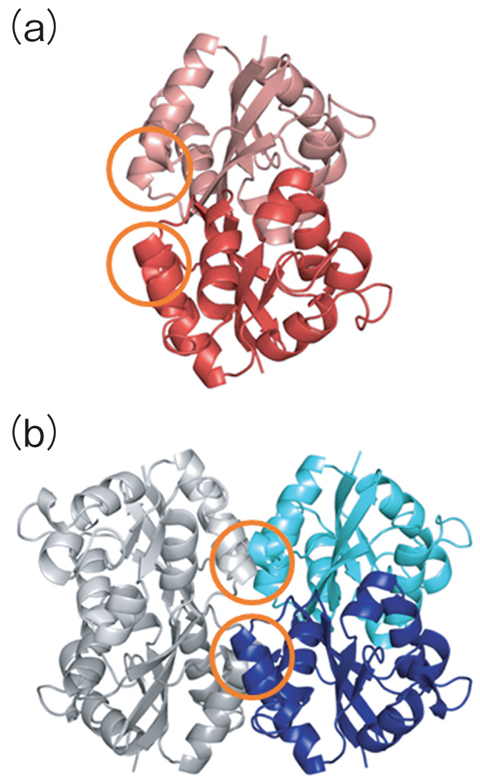
図5-19 HaNDKの立体構造
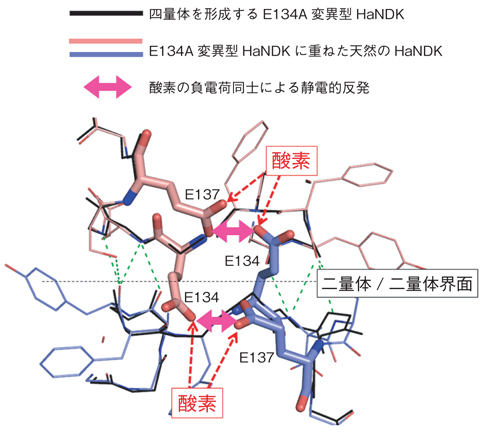
図5-20 天然のHaNDKをE134A変異型HaNDKと重ね合わせた場合の二量体/二量体界面付近
自然界には、会合体を形成することによって初めて機能を発現するタンパク質が存在します。このような会合体形成は、タンパク質の安定性や機能を高めるために有効であることが知られています。私たちは、タンパク質の会合を制御する研究の一環として、ヌクレオシド二リン酸キナーゼ(NDK)の会合状態の操作を試み、分子表面のアミノ酸をわずか一箇所変更することによって二量体から四量体へ会合状態を制御することに成功しました。
NDKは様々な生物の細胞に存在し、二量体以上の会合体を形成します。ほとんどの生物では二量体同士が会合して四〜六量体を形成しますが、1〜2 Mの塩濃度環境に生息する好塩性細菌のNDK(HaNDK)は、例外的に二量体のままです。HaNDKの会合を阻害する原因を探して解消すれば、ほかの生物のNDKと同様に、より高次の会合状態に改変できると考えました。
そこで、X線結晶解析法を用いてHaNDKの立体構造を解明し(図5- 19(a))、構造を詳細に調べることで、二量体以上の会合体を形成しない理由を次のように明らかにしました(図5- 20)。すなわちHaNDKが二量体同士で会合しようとすると、134番目,137番目のグルタミン酸(E134,E137)が、会合相手側のHaNDKのE134,E137に接近します。グルタミン酸の先端には負電荷を持つ酸素原子があるため、E134とE137の間に負電荷による静電的な反発が生じ、会合が阻害されます。
したがって、会合を阻害するE134を変えれば、HaNDKは更に会合すると予想できました。実際、E134を電荷を持たないアラニンAに変更したE134A変異型HaNDKを作製したところ、静電的反発が解消され、四量体を形成させることができました(図5- 19(b))。さらに、四量体HaNDKは二量体の場合よりも19%程度酵素活性が向上しました。
この研究により、X線等の量子ビームを用いて得られるタンパク質の構造情報をもとに、適切な分子設計を行えば、わずかなアミノ酸の変更によって効果的に会合状態を操作できることが実証されました。タンパク質の会合を制御する技術が確立できれば、より高い酵素活性や安定性をタンパク質に付与できる可能性があり、産業的に有用なタンパク質分子の創製につながると期待されます。
本研究は、原子力機構、鹿児島大学の2機関が共同して実施しました。