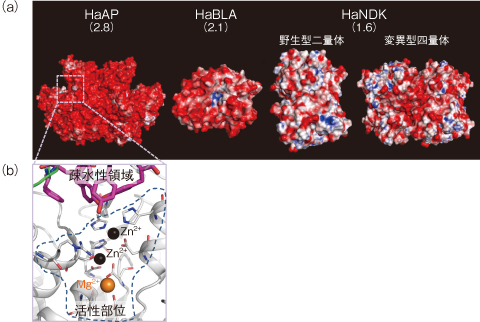
図5-22 原子力機構が解明した好塩菌タンパク質のX線結晶構造
塩湖・岩塩や塩蔵食品等に生息する好塩菌は、高塩濃度環境に適応するために、酸性アミノ酸含量が高い特殊な「好塩菌タンパク質」を作ります。好塩菌タンパク質は、酸性アミノ酸の負電荷によって金属イオンと相互作用しやすい性質があります。私たちはその性質を利用して、東京電力福島第一原子力発電所事故で発生したセシウム等の有害金属や、塩湖等に存在する希少金属を捕集するタンパク質材料の開発を行っています。金属捕集タンパク質の分子設計には、土台となるタンパク質の立体構造情報が必要であるため、私たちはこれまでに図5-22(a)に示した好塩菌タンパク質のX線結晶構造を解明しました。これらのうち、最も酸性アミノ酸含量が高い好塩菌Halomonas sp. 593由来アルカリフォスファターゼ(HaAP)の研究を紹介します。
SPring-8や放射光科学研究施設Photon Factoryを利用してHaAPのX線結晶構造を調べたところ、その表面の負電荷密度(0.0028 e/A2)は、これまでにX線結晶構造が解明されていたほかの好塩菌や大腸菌(通常細菌)のアルカリフォスファターゼ(0.0004〜0.0019 e/A2)よりも顕著に高いことが分かりました。この特徴から、HaAPは希少・有害金属を含む様々な金属イオンと相互作用する可能性があります。
また、一般に好塩菌タンパク質は、塩濃度が下がると酸性アミノ酸間に静電的反発が生じて構造が不安定化し、酵素活性などの機能を失います。しかしHaAPは例外的に1〜4 mol/LのNaClで酵素活性を有します。この仕組みを解明するために、疎水性アミノ酸に着目したところ、HaAP分子内の疎水性アミノ酸(37個)は、ほかの好塩菌や大腸菌のアルカリフォスファターゼ(24〜27個)よりも多いことが明らかになりました。このHaAP分子内の豊富な疎水性アミノ酸や、それによって構成される疎水性領域が、幅広い塩濃度域における構造安定化とそれに伴う酵素活性の保持に寄与する可能性が明らかになりました(図5-22(b))。HaAPの構造を利用すれば、淡水域から塩湖等まで幅広い塩濃度域で利用できる金属捕集タンパク質を創製できる可能性があります。
金属捕集タンパク質を創製すれば、独特な利用方法が可能になります。例えば、金属捕集タンパク質の遺伝子を植物等に組み込んで回収しやすい種子などに発現させれば、生物濃縮による金属捕集が可能になると考えられます。この方法では、長期間にわたって植物が金属捕集を続けるので、ほかの金属捕集材料よりも金属回収の高効率化やコスト削減が期待できます。
本研究は、国立大学法人鹿児島大学と共同して実施しました。