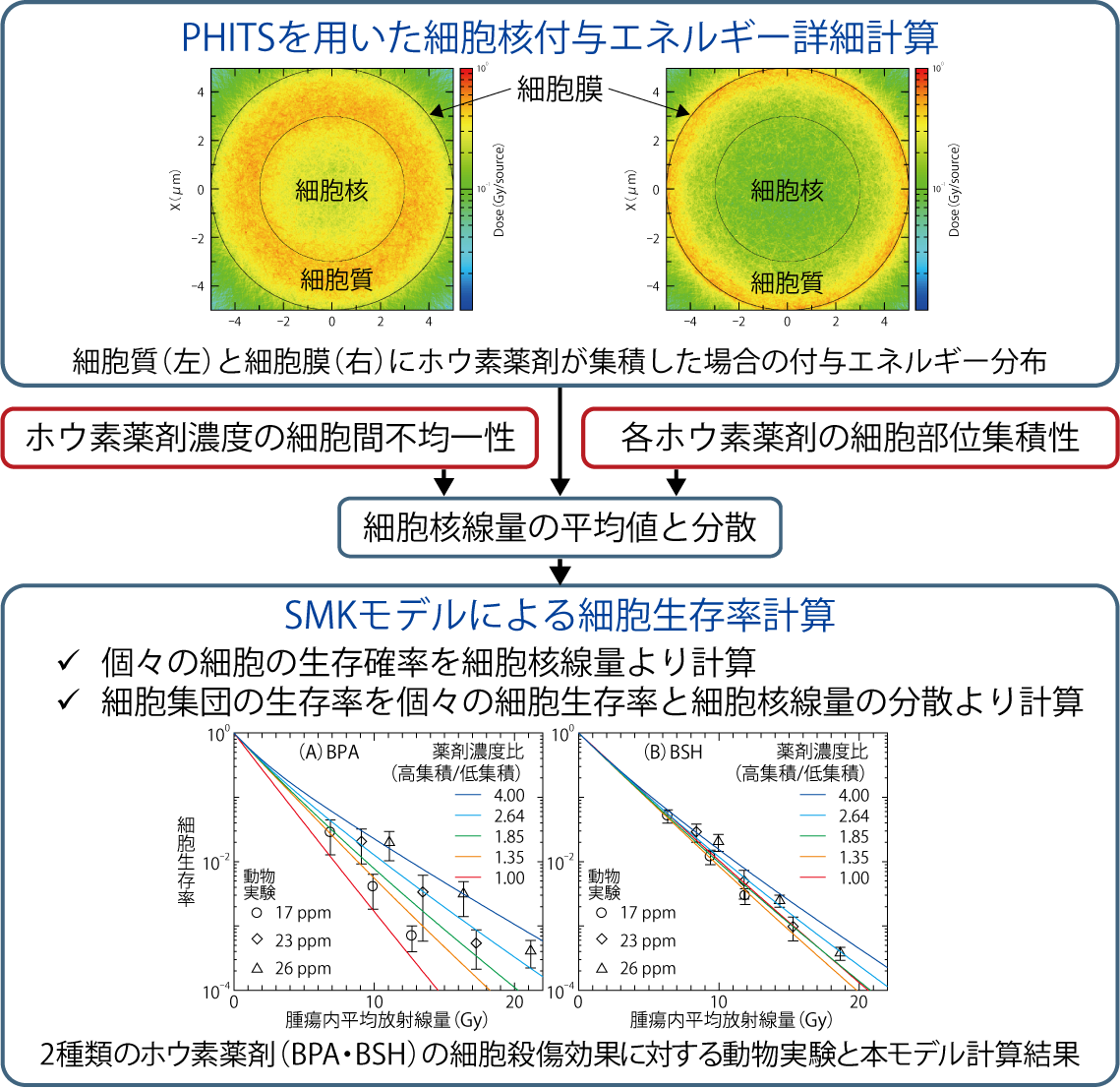
図4-12 本研究で開発した数理モデルによる解析の流れ
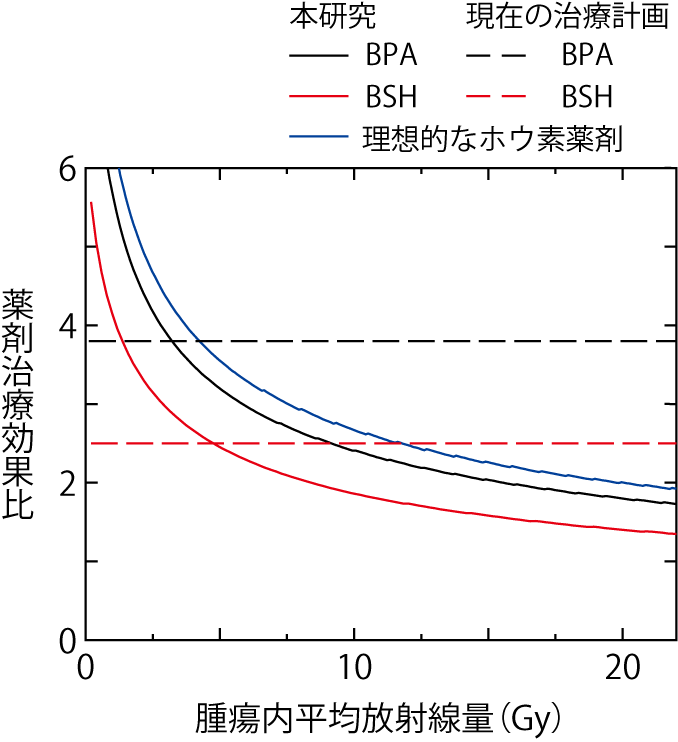
図4-13 様々な薬剤に対する治療効果比の腫瘍内平均線量依存
ホウ素中性子捕捉療法(Boron Neutron Capture Therapy:BNCT)は、あらかじめホウ素薬剤を投与したがん患者に中性子ビームを照射し、ホウ素と中性子の核反応で生じるα粒子やリチウム(Li)イオンを用いてがん細胞を殺傷する治療方法です。体内でα粒子やLiイオンが飛べる距離は細胞1個分程度(〜10 µm)のため、がん細胞に薬剤を集中して取り込ませれば、正常細胞にあまり損傷を与えずにがん細胞のみ選択的に破壊することができます。したがって、がん細胞と正常細胞が混在している悪性度の高い脳腫瘍などに対して特に効果的で、現在、その臨床研究が進められています。
BNCTでは、同じ放射線量でも投与する薬剤の種類や濃度によってがん細胞殺傷能力(治療効果)が異なることが知られています。しかし、その詳細なメカニズムはまだ解明されていませんでした。そこで、本研究では、原子力機構が中心となって開発している粒子・重イオン輸送計算コード「PHITS」と、確率論的マイクロドジメトリ動態モデル(Stochastic Microdosimetric Kinetic Model:SMKモデル)を組み合わせ、BNCTによるがん細胞殺傷効果を理論的に予測する数理モデルを開発しました。
開発した数理モデルによる解析の流れを図4-12に示します。まず、PHITSを用いて、ホウ素薬剤が細胞核、細胞質、細胞膜及び細胞外に局在した場合の細胞核に与えるエネルギーをそれぞれ詳細に計算しました。そして、ホウ素薬剤の細胞部位集積性と細胞間不均一性を考慮し、腫瘍全体の平均放射線量ではなく、細胞生存率により直接的な関係にある細胞核内に限定した放射線量(細胞核線量)の平均値と分散を評価しました。また、得られた細胞核線量の平均値と分散をSMKモデルの入力情報として、個々のがん細胞の生存確率及びそこから推定される細胞集団の生存率を計算しました。その結果、本モデルによる計算値は動物実験結果を良く再現することが分かりました。さらに、得られた結果を基に、腫瘍内平均放射線量と薬剤ごとのX線治療と比べた治療効果比の関係性を推定し、現在の治療計画では低/高線量側での治療効果をそれぞれ過小/過大評価している可能性が高いことを明らかにしました(図4-13)。
本研究により、(1)薬剤治療効果比を高めるためには、より細胞核近傍に集積性を持ち、細胞間に均一に分布するホウ素薬剤の開発が鍵となること、(2)治療計画を高度化するためには、薬剤治療効果比の放射線量依存性を考慮することが重要であることを定量的に明らかにしました。
本研究で開発した数理モデルは、これまで限られた動物実験結果などから経験的に決定されていたBNCTの薬剤治療効果比を理論的に予測可能とするため、今後の創薬研究や治療計画の最適化に役立つと期待されています。
本研究は、日本学術振興会科学研究費補助金基盤研究(C)(No.26461900)「BNCT及びRI内用療法の生物効果比に関する理論的研究」の助成を受けたものです。