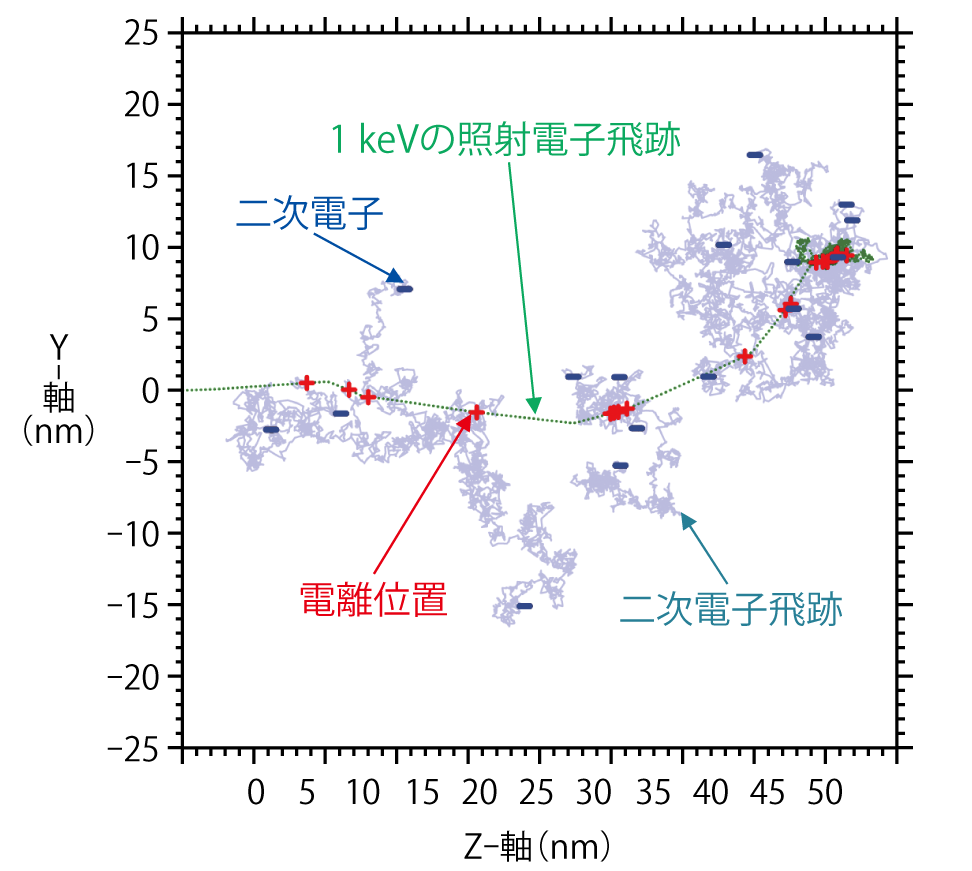
図4-10 水中に1 keV電子線を照射した際の電子飛跡
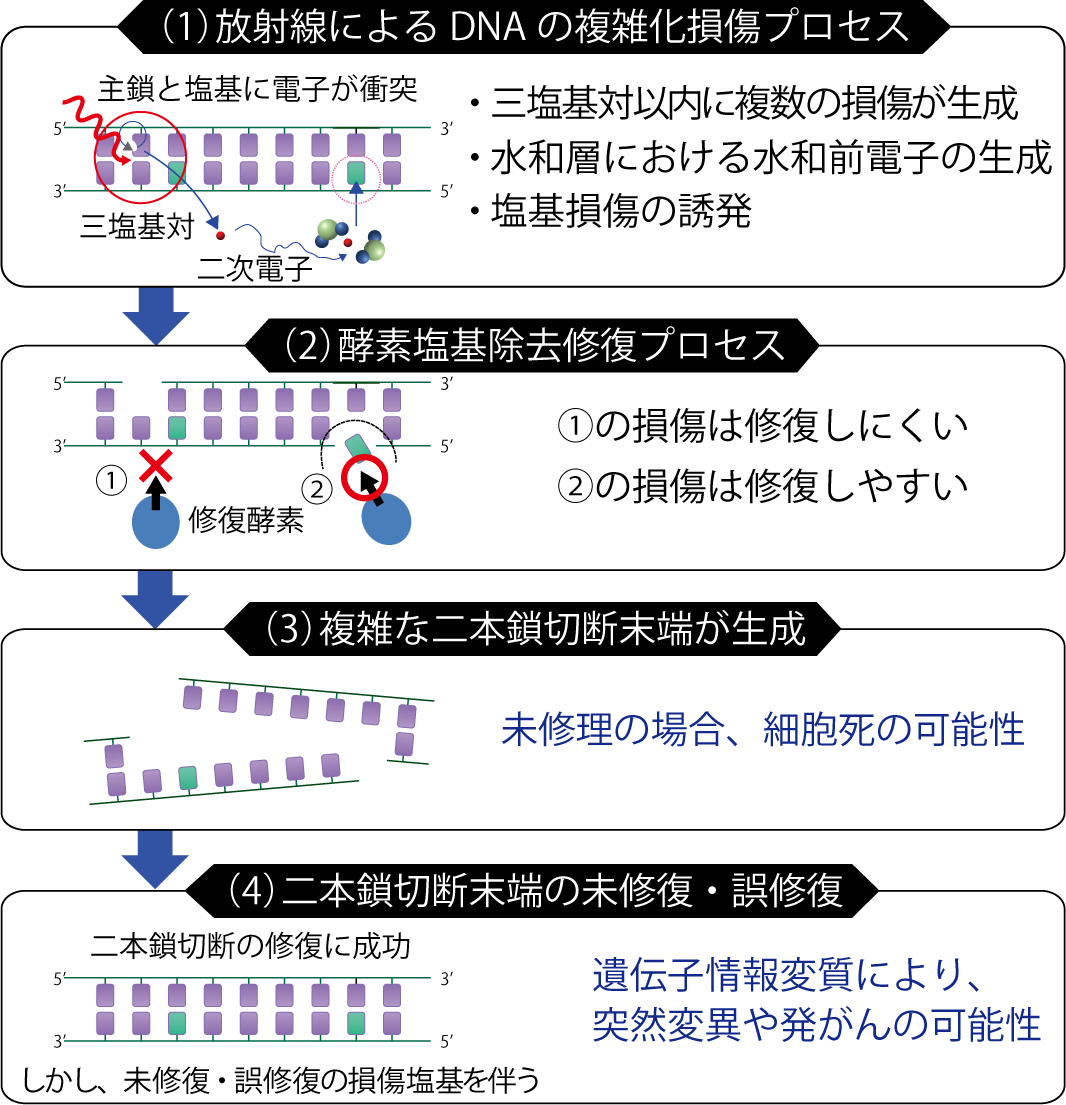
図4-11 塩基損傷を伴う二本鎖切断の生成プロセスと生体影響の関係
細胞中で、遺伝情報を担うDNAが放射線照射を受けると、DNAの二重螺旋の一部切断(一本鎖切断)や完全な切断(二本鎖切断)、遺伝情報を担う塩基の損傷などが生じます。これら損傷の多くは修復されますが、複数の損傷がDNAの1 nm以内で同時に生じた場合、修復される確率が極端に減少することが実験的に示されています。このような損傷はクラスター損傷と呼ばれ、細胞死や突然変異・発がんなどの生物影響を誘発すると考えられています。しかし、放射線照射実験によるクラスター損傷の検出は非常に困難です。
本研究では、DNAへの電子線照射を模擬する電子・正イオン間等のクーロン力を考慮した動的モンテカルロコードを開発し、様々な放射線照射により生体内で生成される電子とDNAとの相互作用を解析しました。図4-10は、1 keVのエネルギーを持つ電子がDNAを含む水中に入射した場合に電離(+の位置)を起こし、二次電子(−)を発生させる様子を図示したものです。計算により、まず、DNAの1 nm以内にDNA鎖切断と塩基損傷を含むクラスター損傷が一定の頻度で発生することを明らかにしました。さらに、1 eV以下の極低エネルギーにまで減速した二次電子は、最終的に電離位置から数nm以上離れた場所に分布し、その近傍にDNAが存在するとDNAに付着して還元的塩基損傷が生成されることを見いだしました。
解析結果から、電子線がDNA中を通過する際に生成されるクラスター損傷部位と、極低エネルギー電子が関与した、孤立した塩基損傷から構成される複雑な損傷が生成され得ることが予測できました(図4-11(1))。このうち、孤立した塩基損傷は修復酵素による除去作用で一本鎖切断に変換されます(図4-11(2))。これがクラスター損傷部位に生じた鎖切断の反対側の鎖に生じると、結果的に二本鎖切断が生成し、この二本鎖切断は切断端近傍に塩基損傷を含みます(図4-11(3))。この場合、二本鎖切断が修復されたとしても、遺伝情報を担う塩基の損傷が残存し、生物影響が誘発される可能性があります(図4-11(4))。
本解析は、極低エネルギー二次電子が生体内で遺伝子情報の変質に関与することを初めて示したものであり、放射線による突然変異やがんの誘発の初期要因を解き明かすための重要な知見となるものです。
本研究は、日本学術振興会科学研究費補助金基盤研究(B)(No.15H02823)「クラスターDNA損傷に対する細胞内修復動態と損傷の局在化メカニズム」、基盤研究(B)(No.16H02959)「イオンビーム生物影響の原因となる二本鎖切断末端に関する研究」、基盤研究(C)(No.17K07022)「イオントラックコアによる微視的複雑体系の放射線作用解明研究」の助成を受けたものです。