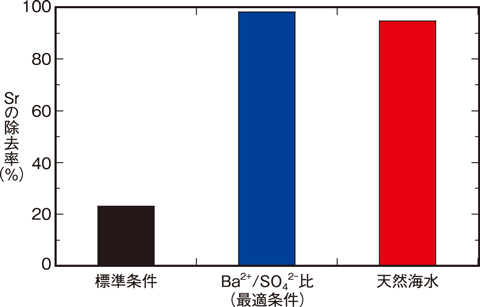
図3-4 バライト生成を利用したSrの除去
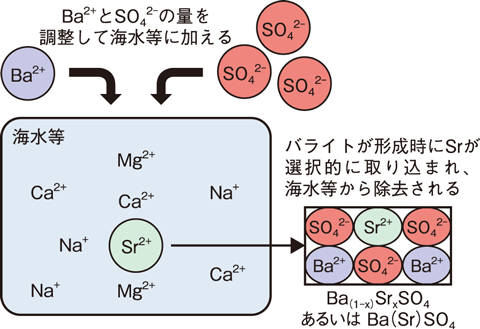
図3-5 バライトの生成を利用して海水等からSrを除去する概念
原子力発電所事故によって放射性ストロンチウム(Sr)が環境中に放出された場合、一般に放射性セシウムよりも土壌等に吸着されにくく、移行性が高いといわれています。特に、海水のように共存元素が多い環境下では、他の元素の影響を受けやすいため、従来の鉱物や樹脂を用いた処理が難しく、有効な除去技術はいまだ開発されていません。そこで本研究では、海水条件下でも適用可能なSrに対する新規の除去方法として、極めて安定な鉱物であるバライト(BaSO4)中にSrを取り込ませることによりSrを除去する手法の開発を行いました。
バライトは、塩化バリウム(BaCl2)の水溶液と硫酸ナトリウム(Na2SO4)の水溶液を混ぜるだけで生成し、沈殿します。そのとき、水溶液中に含まれるSr等の微量イオンがバライトの結晶中に取り込まれます(共沈反応)。本研究では、バライトを生成させるときのSrの除去挙動を、水溶液のpH、加えるBa2+とSO42-のモル比(Ba2+/SO42-)等のパラメーターを様々に変化させた室内実験により詳細に調べ、得られたバライトの鉱物学的な解析を行いました。これらの結果を基に、Sr除去に最適な条件を見いだしました(図3-4)。その結果、バライトによるSrの除去に最も影響を与えるパラメーターがBa2+/SO42-であることが分かり、Ba2+の割合が小さいほど多くのSrが分配されました。このような結果から求めた最適条件において、海水からのSrの除去実験を行ったところ、ナトリウム(Na+)、カルシウム(Ca2+)、マグネシウム(Mg2+)等の海水に多く含まれるイオンによる影響を受けず、海水中のSr(1 mg/L)の90%以上が除去されました。このようにバライト生成条件を最適化することで、これまで困難であった海水条件下でのSr除去が可能になりました(図3-5)。
これらのバライトを用いた元素の除去は、セレンやヨウ素などの福島の汚染水処理で問題となる陰イオン形核種の除去にも有効に働くことが分かっており、より広い応用もまた期待されます。