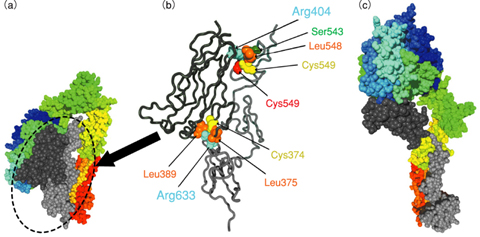
図12-6 インテグリンαVβ3のX線結晶構造(a)とその部分構造(b)及び大規模構造変化後のコンピュータモデル構造(c)
私たちヒトのような多細胞生物においては、個々の細胞は独立して存在しているのではなく、細胞同士は直接あるいは細胞外マトリックスと呼ばれる物質を介して間接的に結合しています。これらの結合には、細胞接着分子という細胞膜上に存在するタンパク質がかかわっています。ここで紹介するインテグリンも細胞接着分子の一種であり、機能と構造の異なる多くの種類のインテグリンが存在することが知られています。
ある種のインテグリンは、通常は不活性な状態にあり、必要な場合にのみ活性な状態にスイッチすることが知られています。血液中の血小板の細胞膜上に多数存在するインテグリンαIIbβ3がその例です。このインテグリンは、怪我などによる出血の際に、活性な状態に変化し、血小板同士の凝集を促進することにより出血を抑えます。このようなインテグリンの活性化には、インテグリンの大規模な立体構造変化(図12-6(c))が伴うと考えられています。
私たちは、αIIbβ3に類似のインテグリンであり、不活性状態の立体構造がX線結晶構造解析により原子分解能で分かっているαVβ3を用いて、インテグリンの大規模な立体構造変化がどのように起きるかを、計算機シミュレーションを用いて調べました。その結果、インテグリンを構成する約1,500個のアミノ酸の中で、インテグリンの大規模構造変化の初期段階や途中の段階において重要な役割を果たすものが存在することを発見しました(それぞれ、図12-6(b)のArg633とArg404)。すなわち、これらのアミノ酸と、空間的に接近しているアミノ酸との相互作用を仮想的に消滅させると、大規模な構造変化が起こりやすくなることが分かったのです。この計算結果は、これらのアミノ酸が、インテグリンの大規模構造変化のためのスイッチの役割を果たしていることを示唆しています。これらのアミノ酸の重要性は、これまで全く認識されていませんでしたが、実際にこれらのアミノ酸が変異して近傍のアミノ酸との相互作用が少なくなるようにすると、インテグリンは活性化することが実験で明らかになりました。これにより、シミュレーション結果の正しさが証明されたと同時に、これらのアミノ酸の重要性が確認されました。
脳梗塞や心筋梗塞などの血栓症は、不必要な場所での血液凝固により引き起こされる病気であり、その治療薬開発においてインテグリンαIIbβ3が注目されています。私たちが、この研究で発見した知見は、今後の血栓症治療薬開発を大きく進展させる可能性があります。