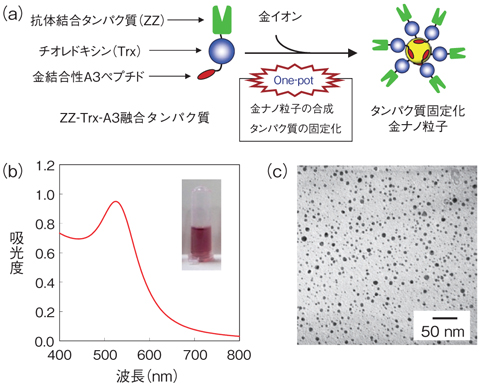
図8-16 ZZ-Trx-A3融合タンパク質を用いた金ナノ粒子の合成とタンパク質の固定化
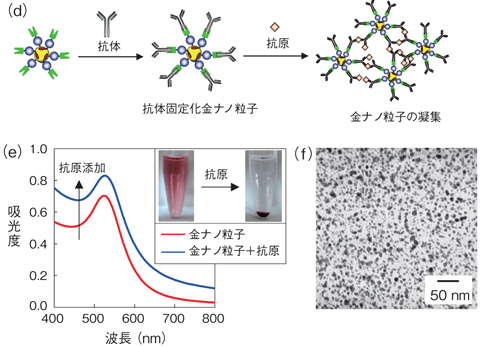
図8-17 金ナノ粒子への抗体の固定化とイムノアッセイ
金ナノ粒子は特異的な分光学的性質を有するため、ナノテクノロジーの分野で注目を浴びています。特に抗体のような生体分子を固定した金ナノ粒子は抗原検出による医療診断などへの利用が可能で、実際に妊娠判定キットへ応用されています。しかしながら、一般的な抗体固定化金ナノ粒子の製法は金ナノ粒子の合成と抗体の固定化の2ステップ以上を必要とするため時間を要します。また、抗体は通常、物理的吸着によって金ナノ粒子へ固定されるため、抗体の安定性や配向性を制御できないという問題がありました。
私たちはこの問題を克服するために、タンパク質にペプチドを融合することで特殊な機能を付与し、この融合タンパク質を用いたタンパク質固定化金ナノ粒子のワンポット合成法を考案しました。具体的には、抗体結合タンパク質(ZZ domain)に金ナノ粒子の保護機能を有するチオレドキシン及び金に対して結合性を有するA3ペプチドを融合した遺伝子組換えタンパク質(ZZ-Trx-A3)を調製しました。このZZ-Trx-A3を金イオンと混ぜたところ、水溶液が赤色に変化し、525 nmに金ナノ粒子特有の表面プラズモン共鳴バンドが観測されました。さらに、透過型電子顕微鏡により、得られた金ナノ粒子は単分散な球状ナノ粒子であり、平均粒子径が4.4 ± 1.6 nmであることを確認しました(図8-16)。この手法を用いた場合、わずか20分で簡便かつ迅速に金ナノ粒子の合成とタンパク質の固定化を同時に行うことが可能であり、数日を要する従来法に比べて高い優位性があります。さらに、得られた金ナノ粒子は半年経過しても水溶液に分散した状態であり、また、高塩濃度水溶液でも凝集しないほどの高い安定性を有しています。
また、私たちは図8-17に示すように、金ナノ粒子上のZZ domainを足場にすることで、抗体を効率良く金ナノ粒子に固定することに成功しました。この抗体固定化金ナノ粒子に抗原を加えたところ、抗原抗体反応により金ナノ粒子の凝集が起こるため、赤色水溶液が濁り、紫外可視吸収スペクトルのバックグランドが増加しました。さらに、数時間放置すると、金ナノ粒子が沈降するため、抗原を目視で検出することが可能です。
この技術はタンパク質に限らず、種々の生体分子固定化金ナノ粒子の合成にも展開できるため、医療診断だけではなく、様々な分野への応用が期待されます。