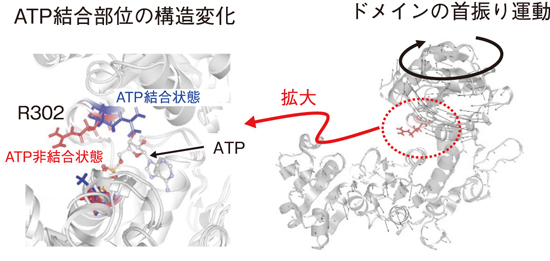
図5-9 ATP結合部位R302(302番目のアルギニンの側鎖)の構造変化(左)とドメインの首振り運動(右)
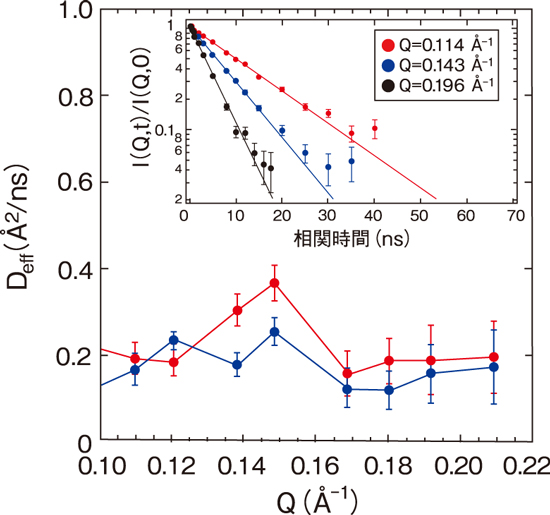
図5-10 ATP非結合状態(赤)とATP結合状態(青)の実効拡散係数DeffのQ依存性
蛋白質はナノメートルサイズのコンパクトな3次元構造であるドメインと呼ばれる構造から構成されます。比較的大きな蛋白質は、複数のドメイン構造から構成され、マルチドメイン蛋白質と呼ばれます。各ドメインは安定した構造を取っている一方で、ドメイン間をつなぐ柔軟なヒンジ領域を介してドメイン構造は相対的に位置や向きを変え、例えば機能部位であるATP結合部位の構造が連動して変化します(図5-9)。このようなドメインスケールでの構造動態を解明することが、酵素活性等の蛋白質の機能発現メカニズムの理解に必要であると考えられています。中性子スピンエコー(NSE)は中性子準弾性散乱測定法で最も高いエネルギー分解能を持ち、ナノメートル及びナノ秒という時空間のスケールで蛋白質の構造とダイナミクス(構造の揺らぎ)を観測できるため、蛋白質のドメイン運動を捉えるのに有効な手法となります。
本研究では、典型的なマルチドメイン蛋白質であるMurDに着目しました。MurDは細胞壁の合成に係る酵素蛋白質であり、ATP(アデノシン三リン酸)結合による構造変化が機能に必須です。しかし、ドメイン構造とATPの結合部位の構造や揺らぎの相関は未解明のままでした。本研究では、NSEと計算科学を組み合わせて、その解明に取り組みました。
図5-10は、NSEで測定を行った結果で、中性子波数Q(0.1~0.22 Å−1)に対する、蛋白質のドメイン運動に由来する実効拡散係数Deffの変化を示しています。ATP非結合状態とATP結合状態のMurDのDeffを比べると、ATP非結合状態で見られる0.15 Å−1辺りのピークはATP結合により小さくなることを発見しました。そして、この動きの抑制がどのようなドメイン運動の変化に由来するのかを分子シミュレーションで詳細に調べたところ、図5-9右で示すような首振り運動のようなドメイン運動と対応することを突き止めました。さらに、計算機よる詳細な解析から、図5-9左に示すように、このドメイン運動はATP結合サイトである302番目のアルギニンの側鎖の揺らぎと連動していることが示され、ドメイン運動によって制御される局所構造の揺らぎがATP結合に重要であることが分かりました。従来の研究では、このようなドメイン運動は全く予測されておらず、ATP結合に伴うドメイン運動の変化の詳細が初めて特定されたことはMurDの酵素活性の分子メカニズムの理解を大きく進展させました。
本研究の解析からは、活性に寄与するアミノ酸残基の構造や揺らぎは熱的にランダムに揺らいでいるのではなく、ドメイン運動という蛋白質全体の協同的な揺らぎによって巧みに制御されていることが見えてきました。蛋白質の構造とダイナミクスは、広い時空間スケールで特徴づけられますが、このような異なる階層間の構造動態の関係性を理解することが、蛋白質の機能解明に重要であることが分かりました。
本研究は、科学技術振興機構戦略的創造研究推進事業(さきがけ)(JPMJPR14L7)「中性子散乱と計算機科学の融合による蛋白質のドメインダイナミクスの解析」の支援を受けたものです。
(中川 洋)